《由結構看出酸的強度》
1. 在前一篇文章『阿瑞尼斯、布-洛、路易士酸鹼學說』曾提到過,強酸的共軛鹼一定是弱鹼;反之,弱酸的共軛鹼一定是強鹼。
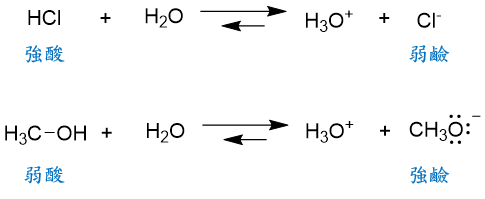
2. 『共軛鹼的穩定性』,是判斷分子酸性強度的指標,越穩定、鹼性越弱的共軛鹼,其共軛酸的強度越強。而影響共軛鹼穩定性的主要因素有電負度、原子大小、共振效應以及誘導效應。
(1) 電負度:
電負度越大的元素越喜歡拉電子,所以承受負電荷的能力越好。承受負電荷的能力越好,即表示這樣的陰離子越穩定,如下圖所示:

C、N、O、F元素形成陰離子時,F的電負度最大,所以它是裡面最穩定的陰離子(最弱的鹼),越弱的鹼它的共軛酸越強,故HF是四種分子中最強的酸。
(2) 原子大小:
同樣帶『-1』的負電荷,若元素的體型比較大,電荷分布的區域較廣(離域的概念),這樣的陰離子就會比較穩定,其共軛酸的酸性會比較強。

(3) 共振效應
共軛鹼上的負電荷可以藉由共振被離域(delocalized),共振通常是穩定陰離子主要效應,當負電荷離域的範圍越廣時,其陰離子越穩定,共軛酸也就越強。

如圖,ethoxide ion 的負電荷被定域 (localized) 在一個氧原子中;acetate ion 的負電荷可在兩個氧原子中離域 (delocalized);methanesulfonate ion 的負電荷可以在三個氧原子中離域。以上三種陰離子(鹼)中,最穩定的是methanesulfonate ion,故其共軛酸是三種裡面最強的。
(4) 誘導效應 (inductive effects)
拉電子(electron-withdrawing)的原子或基團,可以透過sigma鍵來穩定共軛鹼。

如上圖,右邊的結構中多了一個Cl原子,Cl原子的電負度大,拉電子的能力強,能夠透過sigma鍵來將O原子上的負電向左拉,使電荷分布區域更廣(離域),陰離子更穩定,其共軛酸酸性就會更強。
誘導效應的程度,與拉電子原子(or基團)的『數量』、『強度』、『與負電荷的距離』有關。

如上圖,上述四個分子,拉電子的Cl與共軛鹼的負電荷的距離越近,酸性越強(通常計算Cl與O- 距離幾個sigma鍵)。

如上圖可得知,拉電子Cl的數量越多,其酸度越強(分子A、C、D);F的拉電子能力比Cl強,其酸度也會越強(分子A、B)。




 留言列表
留言列表


