原子與原子之間的作用力,我們稱之為『化學鍵』(離子鍵、共價鍵、金屬鍵);而分子與分子間的作用力,有兩種,分別為『凡得瓦力(van der Waals forces)』和『氫鍵(Hydrogen Bonding)』,本篇著重於討論分子間的作用力,並且了解分子間的作用力是如何影響熔點與沸點。
1. 凡得瓦力
以下三種因『庫侖靜電力』所產生的分子間作用力,都稱為『凡得瓦力』:
(1) 偶極-偶極力(Dipole-dipole forces):
極性分子的偶極矩不為零,因此它會有一端帶部分正電,一端帶部分負電。如下圖,若兩個正端或負端相遇,會產生同極相斥的現象;若一個正端和一個負端相遇,則會產生異極相吸的現象。這樣藉由“偶極矩”產生的庫侖靜電力而相吸的力量,我們稱之為『偶極-偶極力』,為“極性分子與極性分子間”主要的作用力。
※若難以理解,我們可以將分子“比喻”為磁鐵,有極性的分子就如同有磁性的磁鐵,本身具有正負兩極,與其他的磁鐵因異極而相吸,這樣的吸引力我們都知道稱為磁力;將這樣的概念套用回分子的身上,我們稱這樣的吸引力為『偶極-偶極力』。
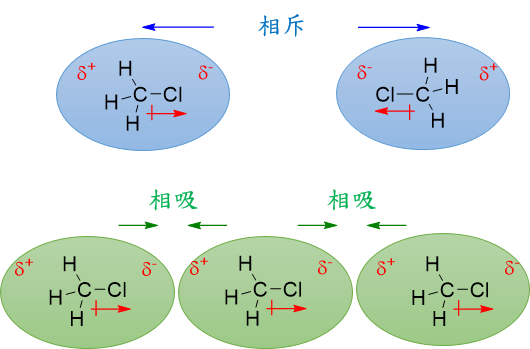
分子排列的方式會傾向於最穩定的型態,因此一般來說會處於異極相吸的排列方式。
若分子的偶極矩(μ)越大,則偶極-偶極力的作用力會越大。
分子量相近的物質,具有極性者,由於其分子與分子之間有“偶極-偶極力”,分子間的作用力越大,則沸點越高。
p.s為何分子間作用力會影響沸點、熔點與溶解度本篇後面會詳細說明
(2) 倫敦分散力:
非極性分子因本身沒有極性,其偶極矩為0,故非極性分子之間沒有偶極-偶極力來互相吸引。非極性分子與非極性分子之間,是靠一種叫做『倫敦分散力』的作用力來互相吸引的。事實上,不論是極性分子還是非極性分子,都具有倫敦分散力。
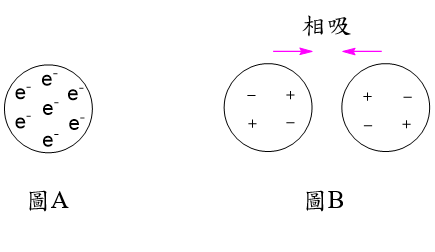
非極性分子的偶極矩為零,其單獨存在時,分子本身的電子雲是分布均勻的(如下圖A)。但是一旦遇到另外一個非極性分子時,會發生暫時性的電子雲分布不均,產生暫時性的偶極矩,有了暫時性的偶極矩就會產生庫侖靜電力,非極性分子之間就可以互相吸引(如下圖B),這樣的分子間作用力我們稱之為『倫敦分散力。』
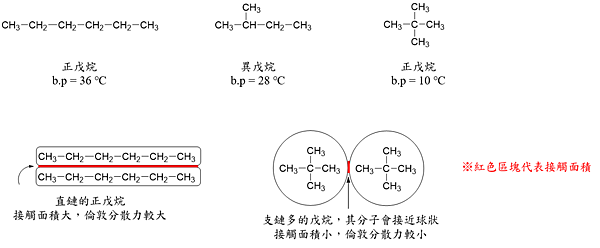
由於倫敦分散力是因為分子與分子的接觸,才產生庫侖靜電力而相吸,也就是說分子與分子之間的『接觸面積』越大,其倫敦分散力越大。如下圖,正戊烷、異戊烷與新戊烷,這三個化合物的分子式相同,卻因分子排列方式與接觸面積不同,而導致倫敦分散力有差異。
(3) 偶極-誘導偶極力:
與倫敦分散力的概念相似,不過這次的情況是指,當極性分子靠近非極性分子時,非極性分子會受到極性分子的靜電感應,發生暫時性的極化現象,產生庫侖靜電力,此時極性分子與非極性分子之間因庫侖靜電力而相吸的作用力,我們稱之為『偶極-誘導偶極力』
※概念與國中理化所學的“靜電感應”相似

圖片來自於網路:
2. 氫鍵
(1)『氫鍵』這個名詞中雖然含有『鍵』字,但它不是一種化學鍵結,而是一種較強的『分子間的作用力』,氫鍵雖然比一般的化學鍵(共價鍵、離子鍵、金屬鍵)弱,卻比凡得瓦力強。
(2) 當氫原子(H)與電負度大、具有孤對電子的原子(通常是N和O)鍵結,形成的O—H和N—H即為氫鍵,有以下兩種種類:
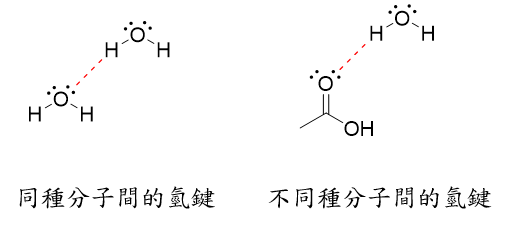
分子間氫鍵:
在兩個分子中發生(這兩個分子不一定會是同種)
Ex:
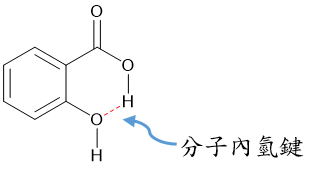
分子內氫鍵:
在同一個分子中形成,通常分子長到形成氫鍵時,可產生五~七員環。
Ex:
3. 分子間作用力影響沸點與熔點
(1) 物質有三態,固態、液態與氣態,影響物質型態的關鍵在於『分子間的作用力』,分子間的作用力弱,則分子與分子之間抓不住彼此,容易變成氣體逸散在空氣中;分子間的作用力強,分子與分子可以牽住彼此,可以形成液態;若分子間的作用力強且堆積方式再更緊密時,可以固體型態存在。
(2) 固體熔化成液體此時的溫度稱為熔點(m.p);液體汽化成氣體,此時的溫度稱為沸點(b.p)。若分子間的作用力越強,我們需要升更高溫來給予更多能量,去破壞這個作用力,物質才能熔化或汽化。也就是說,一個物質的分子間作用力越強,其沸點與熔點也會越高。
(3) 分子間的作用力強度比較:
氫鍵 > 偶極-偶極力 > 倫敦分散力與偶極-誘導偶極力
若有氫鍵的產生,分子間的作用力會比較強,熔沸點會比預期來的高;若沒有氫鍵,則依照以下順序來進行比較(方法不是絕對,但適用於大多數例子)
沸點:分子量→極性→接觸面積
分子量大的物質,分子中所含的電子數越多,其靜電吸引力越強,分子間的作用力就越大,其沸點就會越高,因此優先比較分子量。接著,偶極-偶極力的強度大於倫敦分散力,所以其次比較極性大小,最後比較接觸面積。
※小提醒:偶極-偶極力強度與極性大小有關;倫敦分散力強度與接觸面積大小有關。
熔點:分子量→對稱性→極性
優先比較分子量的原因同上。再來前述有提到,若分子的堆積模式夠緊密,則物質可以固體的形式存在,所以說固體熔化成液體的『熔點會與堆積模式』有關,又『分子的堆積模式與對稱性』有關,越對稱的分子可以堆積得比較緊密,故其次比較對稱性,最後才比較極性。
Ex:

如圖,先討論沸點,A和B的分子量相同,其次比較極性大小,A為非極性分子,B為極性分子,故B的沸點比較高。
再來討論熔點,A和B的分子量相同,其次比較對稱性,A明顯比B來得對稱,因此A的熔點比較高。




 留言列表
留言列表


